Продовження фахових розповідей про збудник COVID-19 (а також його родичів та друзів) від автора університетського підручника “Вірусологія”, доцента нашої кафедри Сергія Шамрая (доступний за посиланням). Читайте також першу та другу частини на нашому сайті, якщо Ви досі цього не зробили.
Ось і третій есей щодо коронавірусів. Чи мабуть навіть невелика оповідь. Поговоримо про інтимне життя SARS-CoV і SARS-CoV-2. Тому, хто очікує, що мова буде про щось непристойне, нагадаю, що слово «інтимний» має багато відтінків, зокрема «неплатонічний». А взаємодію цих вірусів з клітинами нашого організму важко назвати платонічними. До того ж до вірусів неможливо застосувати слово «життя», принаймні у побутовому значенні.
Мова буде йти про деякі подробиці циклу реплікації двох вірусів. Вони загалом близькі за складом, використовують однакову стратегію паразитування у клітині хазяїна, але SARS-CoV вивчений набагато краще (його вивчають з 2002 року), тому багато відомостей ми обґрунтовано можемо екстраполювати на SARS-CoV-2.
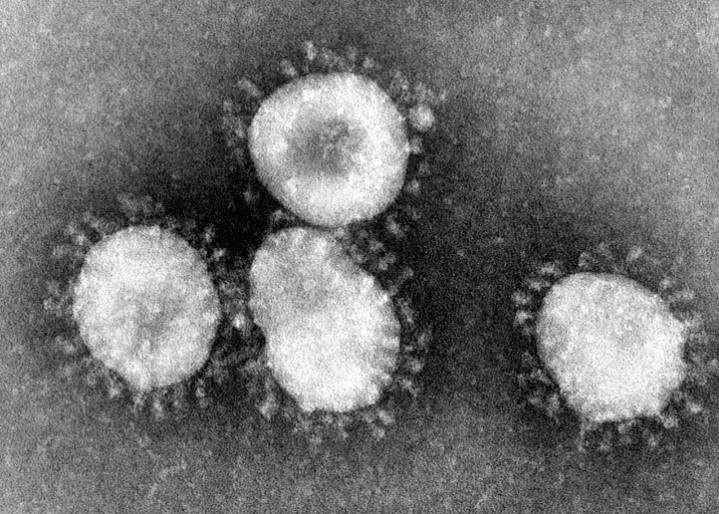
Нагадаю, вірусна частка (віріон) SARS-CoV-2 містить геном с позитивно сенсовою РНК (+РНК), яка укладена у спіраль разом з білком N, і цей нуклеокапсид оточений ліпопротеїновою мембраною (оболонкою), на який добре помітні вирости, які нагадують сонячну корону. Ці вирости інколи називають «шипами», але така назва не зовсім коректна, тому що вони не гострі і не жорсткі. Хоча англійська їх назва spike також означає шип, гвіздок, костиль (якім щось прикріплюють) тощо. Але я вважаю за краще звати їх виростами або виступами. Хоча можливо вирости також недобре, тому що вони не ростуть. Але хай вже буде. Нижче наведені електронна мікрофотографія віріонів і схематичне зображення їх структури.
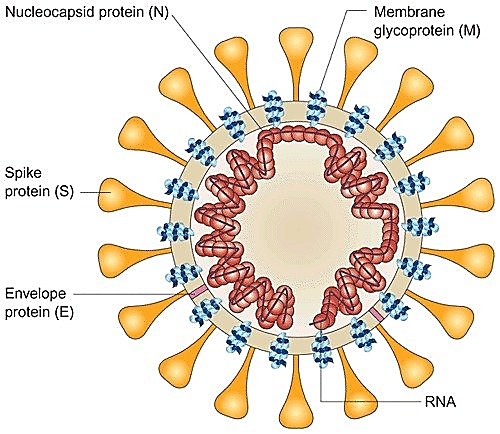
(+)РНК-геном означає, що вірусна РНК є з одного боку геномом, а з іншого боку вона є матричною РНК (мРНК) і може безпосередньо транслюватися рибосомами з утворенням пептидних ланцюгів. Тобто безпосередньо на вірусному геномі синтезуються білки. Негативно сенсова РНК ((-)РНК) комплементарна до (+)РНК.
Дозволю собі ліричний відступ. Україно- і російськомовні біохіміки і молекулярні біологи часто чомусь полюбляють мРНК називати інформаційною РНК (іРНК), що є безглуздим. У англомовній літературі матричну РНК називають messenger RNA (mRNA), мессенджер-РНК, тобто РНК-посильний. Дійсно, вона є посильним між геномною ДНК і рибосомами, які синтезують на її матриці білок. Вона містить інформацію про послідовність амінокислотних залишків у поліпептидному ланцюгу. Але так само інформацію щодо послідовності амінокислот містить і (-)РНК, але у комплементарному вигляді! Тобто (-)РНК також є інформаційною, і багато вірусів мають саме геноми у вигляді (-)РНК! Але безпосередньо вона не може правити за матрицю для синтезу пептидів, і за визначенням не є інформаційною РНК. Саме тому називати мРНК інформаційною РНК є нонсенсом. Але багато наших шановних біохіміків і молекулярних біологів чомусь на це не зважають. Ну, загалом це не мій клопіт.
Коли коронавірусні частки потрапляють у потенційного хазяїна (наприклад, у когось з нас), перше, що їм треба зробити – це потрапити усередину сприйнятливих клітин. В першу чергу їм потрібно перетнути плазматичну мембрану, яка оточує кожну нашу клітину. А це – не тривіальна задача, тому що мембрана є напрочуд надійним бар’єром, який не дозволяє потрапляти до клітини тому, що туди потрапити не повинно. Ось тут віруси вдаються до хитрощів. Для приєднання до поверхні клітини вони використовують поверхневі білки-рецептори, які в нормі виконують важливі для клітини функції. І після зв’язування з рецептором вірус поглинається клітиною.
Вірус має так звані білки прикріплення, або антирецептори, які специфічно підходять до певного рецептора, як ключ до замка. Власне кажучи, віруси і здатні заражати тільки ті клітини, на поверхні яких є відповідні рецептори. І, наприклад, вірус імунодефіциту людини приєднується тільки до білків (CD4), які мають деякі клітини імунної системи, але не мають наприклад клітини легень. І навпаки, SARS-CoV і SARS-CoV-2 інфікують клітини легень, але не інфікують клітини імунної системи, тому що на останніх немає потрібного рецептора.
Рецептором, з яким зв’язується віріон SARS-CoV-2, є ангіотензинперетворюючий фермент 2 (angiotensin-converting enzyme 2, ACE2). Цей же рецептор використовує і збудник атипової пневмонії SARS-CoV. З боку вірусних часток білком прикріплення є як раз білок, який формує вирости на поверхні вірусних часток (білок S). Цікаво зазначити, що збудник близькосхідного респіраторного синдрому MERS-CoV у якості рецептора використовує іншій білок – DPP-4.
Білок S є тримером, тобто формується трьома однаковими поліпептидними ланцюгами. Він привертає багато уваги дослідників, тому що знаходиться на поверхні вірусної частки і можна очікувати, що саме з ним будуть взаємодіяти наївні В-лімфоцити, щоби перетворитися на клітини плазми крові і почати виробляти противірусні антитіла. Тобто саме білок S може бути антигеном при створенні вакцини проти SARS-CoV-2. Доменна структура цього білка наведена нижче.
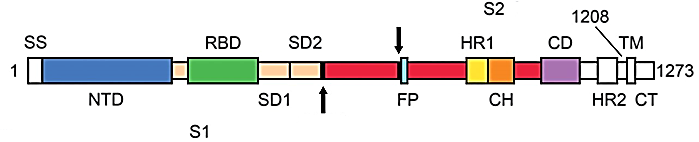
Кого цікавить детальна інформація щодо тривимірної структури білка S і її динаміки, вам сюди, сюди і сюди.
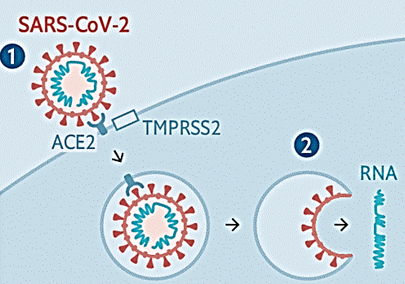
Коли вірус приєднується до рецептора, клітина вважає, що рецептор активувався природнім лігандом, і поглинає цей рецептор шляхом ендоцитозу з утворенням ендосоми. Але замість природного ліганду до клітини потрапляє вірусна частка! Тут важливо зрозуміти, що на цьому етапі вірусна частка потрапила в середину клітини, але не в цитозоль. Вірусна частка залишається оточеною мембраною ендосоми, а геном вірусу залишається оточеним ліпопротеїновою оболонкою власної вірусної частки. Щоби потрапити в цитоплазму, повинно відбутися злиття мембрани ендосоми з оболонкою вірусної частки, і саме тоді нуклеокапсид потрапить до цитозолю так би мовити автоматично.
Це відбувається наступним чином. Передбачається, що протеаза хазяїна TMPRSS2 розрізає рецептор ACE2, це потрібне для ендоцитозу і звільняє ділянку мембрани ендосоми. Надалі білок S також розрізається протеазою хазяїна (відбувається праймування (priming) білка S) між субодиницями S1 і S2. Як ми бачили на малюнку вище, цей білок має два потенційних сайти розрізання протеазою. Але у спеціалістів є поки що деяка непевність, які саме протеази розщеплюють білок S. Можлива участь тієї ж TMPRSS2, або це можуть бути фурін, трипсин, катепсин чи протеаза, схожа на трипсин в дихальних шляхах людини (human airway trypsin-like protease). Але в деяких публікаціях зовсім не вказують на те, що TMPRSS2 розрізає рецептор ACE2; ця протеаза тільки розрізає білок S у двох сайтах, активуючі злиття мембран.
Як би там не було, субодиниця зв’язування з рецептором S1 відрізається, активується субодиниця злиття мембран S2 і відбувається злиття мембран оболонки віріона і ендосоми. І геном вірусу нарешті опиняється у цитоплазмі, як показано на малюнку:
Схематичне зображення генома SARS-CoV-2 наведено нижче на малюнку. Нагадую, ORF означає відкриту рамку зчитування (open read frame).
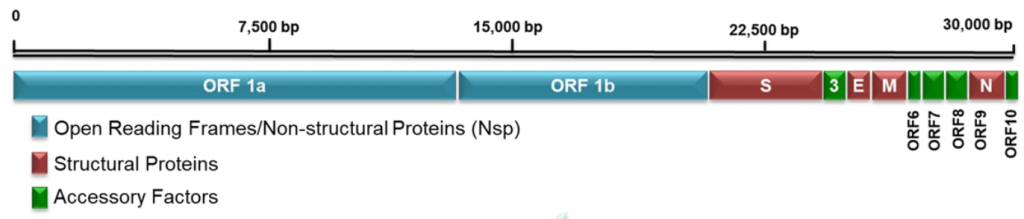
Оскільки геном вірусу є одночасно мРНК, зразу ж починається його трансляція, тобто рибосоми клітини хазяїна, натрапивши на нього, починають синтезувати вірусні білки. На наведеній схемі різним кольором показані неструктурні, структурні і допоміжні білки SARS-CoV-2.
Тут треба знову зробити ще один ліричний відступ. У вірусів з геномами РНК є проблема. Фермент, якій повинен реплікувати цю РНК і здійснювати транскрипцію (синтез мРНК на (-)РНК), є РНК-залежною РНК-полімеразою. Але наші клітини його не мають! Ну немає у нас синтезу РНК на матриці РНК. Неможна сказати, що живі організми зовсім не мають РНК-залежної РНК полімерази, її мають рослини і деякі протисти. Але віруси цей фермент використовувати не можуть. Вони повинні кодувати свій власний фермент. Деякі фахівці навіть пропанують для вірусного ферменту назву РНК-залежна РНК полімераза (RNA-dependent RNA polymerase), а для ферменту живих організмів назву РНК-спрямована РНК полімераза (RNA-directed RNA polymerase). Але зараз щодо вірусів використовують обидві назви, нажаль. Таким чином, вірусу цей фермент потрібен для транскрипції і трансляції, і віруси або мають його в своїх вірусних частках (віруси з (-)РНК-геномами і з геномами, представленими дволанцюговими РНК), або він зразу ж синтезується у клітині на геномі у вірусів з (+)РНК-геномами, такими як SARS-CoV-2.
Але у вірусів з (+)РНК-геномами є ще одна проблема. Їх геном, як ми знаємо, фактично є мРНК, але ця РНК поліцистронна, тобто має декілька відкритих рамок зчитування, кожна з яких має стартовий кодон і стоп-кодон. От стоп-кодон і є проблемою. У нашого коронавірусу зразу ж буде транслюватися перша відкрита рамка зчитування (ORF1a, див. малюнок). Але коли зустрінеться її стоп-кодон, рибосома від’єднається. А правіші (downstream) рамки зчитування, як же їх транслювати? Віруси вирішують цю проблему різними шляхами, дещо про це сказано у нашому з Дмитром Вікторовичем Леонтьєвим підручнику.
Що стосується SARS-CoV-2, то після попадання в клітину і «роздягання» геному відбувається кеп-залежна трансляція ORF1a з утворенням поліпептиду pp1a. Крім того, завдяки «слизькій» ділянці на РНК біля кінця ORF1a у 25-30% відбувається зсув рамки зчитування (-1 фреймшифтінг), завдяки чому транслюються ORF1a і ORF1b з утворенням більшого поліпептиду pp1ab. Надалі відбувається автокаталітичне розрізання цих поліпротеїнів з утворенням численних функціональних білків. Знаменно, що серед цих білків є РНК-залежна РНК полімераза, яка здійснює транскрипцію зокрема з утворенням субгеномних РНК (що є ще одним способом вирішення проблеми стоп-кодонів) і реплікацію генома. Схематично цикл реплікації SARS-коронавірусів зображений нижче.
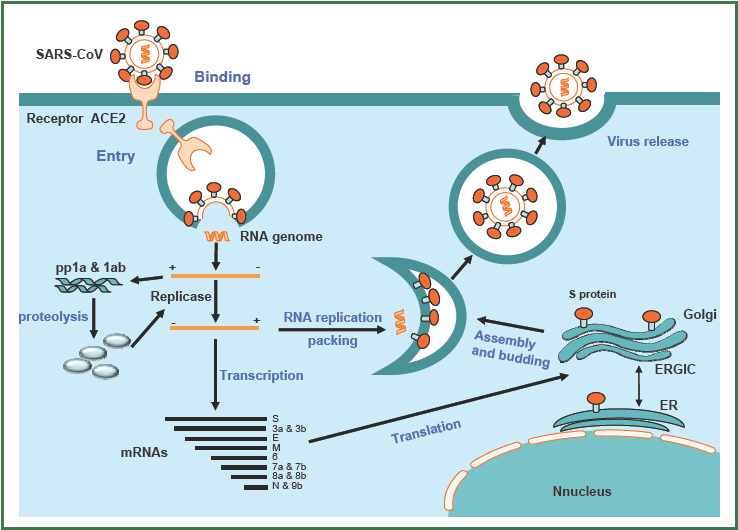
Я не буду перераховувати усі численні вірусні білки, які синтезуються в клітині. Ці білки виконують численні функції, починаючі від запобігання імунної відповіді клітини і примушення клітини синтезувати вірусні білки, а не свої власні, і закінчуючи утворенням нових вірусних часток. Детальний аналіз білків з відомими і невідомими функціями наведено тут.
Коли у клітині буде напрацьована певна порогова кількість структурних вірусних білків і нових вірусних геномів, нові вірусні частки самозбираються і покидають клітину. Цікаво, що вірусні білки, які потраплять до оболонки вірусних часток, остаточно синтезуються і модифікуються в комплексі Гольджі. Новоутворені нуклеокапсиди брунькуються через мембрану бульбашок Гольджі, так що віріони придбавають власну мембрану, і оточені зверху ще однією мембраною. Надалі вони вивільняються з клітини шляхом екзоцитозу. Пишуть, що одна клітина може вивільнити 100-1000 вірусних часток, а потім гине.